Wat is verdamping?
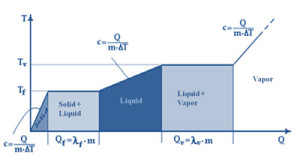
Verdamping is het overgaand van vloeistof naar gasvormige staat, waarbij de impact slechts op het oppervlak van de vloeistof is. Anderzijds, als de kooktemperatuur (verschillend voor elke specifieke vloeistof en druk) wordt overschreden, zal de constantheid van de temperatuur en druk parameters het kookproces doen plaatsvinden. Beide processen vallen onder de noemer verdamping.
Vacuümverdampers maken gebruik van een natuurlijk fenomeen: verdamping. Zij werden 35 jaar gelden voor het eerst geproduceerd en ontworpen met een vooruitziende blik. Die bewees dat de acceleratie van dit fenomeen, door het gebruik van pakket-modulaire standaard units, een “schoon systeem” te zien geven. Dat water separeert van alle vervuilde componenten met een hoger kookpunt dan water.
Wat is latente warmte?
Teneinde de verandering van de toestand te creëren, genaamd latente warmte verdamping, dient eerst verwarming (energie) geleverd te worden. Hoeveelheid hangt af van het type vloeistof en van haar massa en temperatuur. Bij voorbeeld, de latente warmte van 1 kilo water bij 373 K (100°C) is ongeveer 2.300 kJ (550 kcal, 640 Wh) bij atmosferische druk. (ca. 100 kPa).
Wat is het kook punt?
Dit is het temperatuurpunt waarbij dampdruk de externe drukwaarde (vast) bereikt, verdamping ontstaat hierbij op een tumultueuze wijze (koken), die niet alleen het oppervlak van de vloeistof , maar ook de totale massa beïnvloedt. Kook temperatuurpunt hangt af van het vloeistof type en varieert, afhankelijk van druk. Water kookpunt is 100°C, met een atmosferische druk van 100 kPa. Maar op grote hoogte met een lagere temperatuur, waar de druk lager is, kookt water op een lagere temperatuur. Wanneer de druk zeker laag is (vacuüm) en gelijk aan 4 kPa (40 mbar), wordt de kooktemperatuur bereikt op 29°C.
Verschillende vloeistoffen hebben verschillende kookpunten.
Wat is ebullioscopie verhoging?
In geval van zoutoplossingen, verandert de kooktemperatuur, die plaatsvindt bij constante druk, door de aanwezigheid van zouten en hun concentraties. Ebullioscopie verhoging is hierdoor het kooktemperatuur verschil tussen water en een oplossing van een vaste concentratie zouten. Bij voorbeeld, de kooktemperatuur van een oplossing van NaCl bij 35% w/w in water, bij atmosferisch drukniveau zal een 10K (bij 37°C) verhoging van kooktemperatuur te zien geven.
Lees hier meer over wat verdamping.